此次士澤生物與合作醫院完成的全中國首例�、全世界第二例臨床級自體iPS衍生細胞治療帕金森病的神經(jīng)外科微創(chuàng )手術(shù)移植在兩小時(shí)以?xún)韧瓿桑?strong style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important; visibility: visible;">首例受試者接受臨床級iPS衍生細胞移植后�,無(wú)手術(shù)及圍術(shù)期的并發(fā)癥或其他不良安全事件��,各項檢測指標正常且已順利出院�����,平穩度過(guò)觀(guān)察期并進(jìn)入正式隨訪(fǎng)期�。

此次已成功實(shí)施的中國首例iPS衍生細胞治療帕金森病移植給藥���,由國家衛生健康委員會(huì )和國家藥品監督管理局(簡(jiǎn)稱(chēng)兩委)正式批準開(kāi)展臨床:是我國首個(gè)經(jīng)國家兩委局批準開(kāi)展的iPS衍生細胞治療帕金森病的臨床研究��,也是我國迄今為止唯一一個(gè)正式獲批的iPS衍生細胞治療神經(jīng)系統疾病的國家級干細胞備案臨床研究項目(批準開(kāi)展臨床號:MR-31-24-001927)(推薦閱讀:【國內首個(gè)】士澤生物iPSC衍生細胞治療帕金森病獲批國家級備案臨床研究)

帕金森?��。≒arkinson's disease��,PD)是全球第二大神經(jīng)退行性疾病��,我國是全球帕金森病第一大國����,帕金森病主要致病原因為中腦黑質(zhì)區多巴胺能神經(jīng)元發(fā)生了退行性病變和死亡�,進(jìn)而引起震顫�����、運動(dòng)遲緩���、肢體僵硬�����、步態(tài)異常等運動(dòng)功能的逐步退化�����,直至病人死亡���。我國65歲以上人群中�����,帕金森病發(fā)病率約為1.7%�,預計至2030年�����,我國帕金森病患者人數將達到500萬(wàn)左右����,現有的傳統藥物治療或手術(shù)治療不能再生多巴胺能神經(jīng)元或解決神經(jīng)元退行性病變和死亡的問(wèn)題��,尚不能改變帕金森病的疾病發(fā)展進(jìn)程�。
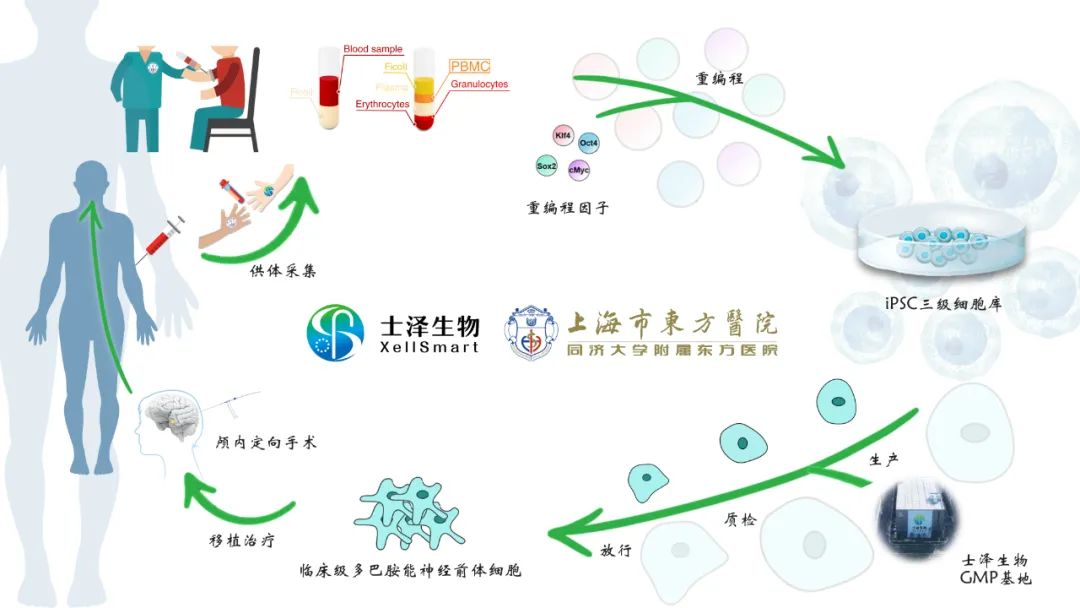
本次士澤生物與上海市東方醫院合作完成的全中國首例��、全世界第二例自體iPS衍生細胞替代性移植治療中重度帕金森病�,依托士澤生物已建立的一站式全流程的臨床級iPS衍生亞型多巴胺能神經(jīng)前體細胞注射液的制備工藝流程�、質(zhì)量控制及制劑放行體系:
對患者自體來(lái)源的供體細胞建系的臨床級iPS細胞庫進(jìn)行臨床級亞型多巴胺能神經(jīng)前體細胞的誘導分化��,在克服異體細胞移植可能產(chǎn)生免疫排斥影響細胞存留及功能活性的同時(shí)����,通過(guò)顱內立體定位注射神經(jīng)外科微創(chuàng )手術(shù)方式進(jìn)行神經(jīng)再生性移植治療�����,對中國首例式臨床研究再生多巴胺能神經(jīng)細胞移植治療帕金森病的安全性并分析對帕金森病患者療效的影響具有重要的標桿意義�。
士澤生物誘導制備的高純度亞型特化多巴胺能神經(jīng)前體神經(jīng)細胞產(chǎn)品質(zhì)量標準已達國際領(lǐng)先水平���,并已在臨床前帕金森病小動(dòng)物模型及中重度帕金森病非人靈長(cháng)類(lèi)模型上進(jìn)行了系統的評估和驗證����,成藥性?xún)?yōu)異���,論證了士澤生物iPS衍生多巴胺能神經(jīng)前體細胞移植治療安全有效�����。士澤生物已建設完成的>5000平方米的研發(fā)中心���、GMP中試基地及質(zhì)控中心可充分保障獲國家兩委局正式批準開(kāi)展的中國首個(gè)iPS衍生細胞藥治療帕金森病臨床研究項目的臨床級iPS衍生多巴胺能神經(jīng)前體細胞制劑的生產(chǎn)���、質(zhì)控和放行�����。
士澤生物創(chuàng )始人李翔博士表示:士澤生物此次順利完成的臨床給藥:為中國首例臨床級iPS衍生細胞移植治療帕金森病��,也是全中國首例�、全世界第二例個(gè)性化自體iPS衍生細胞替代性移植治療帕金森病�����,為中國iPS衍生細胞治療帕金森病留下了中國“首個(gè)及首例”的行業(yè)記憶���!
士澤生物此次開(kāi)展的臨床研究項目由國家衛生健康委員會(huì )和國家藥品監督管理局正式批準開(kāi)展:是我國首個(gè)iPS衍生細胞治療帕金森病的國家級備案干細胞臨床研究項目����,也是我國迄今為止唯一一個(gè)獲得國家兩委局正式批準開(kāi)展的iPS衍生細胞治療神經(jīng)系統疾病的國家級臨床研究項目����。
士澤生物獲得兩委局正式批準開(kāi)展中國首個(gè)臨床研究及已經(jīng)順利完成個(gè)性化自體iPS衍生多巴胺能神經(jīng)前體細胞的臨床級注射液的生產(chǎn)�、質(zhì)檢����、放行及與合作醫院完成的臨床微創(chuàng )移植���,是對士澤生物自主運營(yíng)和已經(jīng)建立的臨床級iPS衍生細胞注射液治療帕金森病的整體產(chǎn)品及管理體系��,和GMP規范下的臨床級iPS衍生細胞的“生產(chǎn)-制備-放行”的一站式平臺能力的重要驗證和論證�。
相對美國已經(jīng)完成全世界第一例的實(shí)驗室級別自體iPS衍生細胞移植治療帕金森病�����,中國士澤生物自研及國產(chǎn)的臨床級iPS衍生細胞注射液�����,具有多方面的顯著(zhù)對比優(yōu)勢��,其中�����,士澤生物的治療成本不及美國同類(lèi)治療成本的三十分之一����,對追求個(gè)性化治療帕金森病有實(shí)質(zhì)需求的中國及全球帕金森病患者更加經(jīng)濟可及��,具有明確的市場(chǎng)化競爭優(yōu)勢(推薦閱讀:花費1400萬(wàn)��,他雇傭頂尖團隊給自己做了這臺世界首例移植術(shù))
自士澤生物在合作醫院發(fā)起臨床招募以來(lái)�,全國帕金森病患者報名意愿強烈�,更加凸顯出作為全世界帕金森病第一大國����,中重度帕金森病未被滿(mǎn)足的重大臨床剛需�����。士澤生物團隊將嚴格遵守醫學(xué)及倫理要求��,與合作醫院臨床及管理團隊一起����,以科學(xué)嚴謹的態(tài)度推進(jìn)后續國家級干細胞備案臨床研究工作�,不忘初心��,不懈進(jìn)?��。?/span>
期待最終能夠為帕金森病患者開(kāi)發(fā)出安全����、有效����、可控及經(jīng)濟可及的�,或實(shí)現高價(jià)值個(gè)性化醫療的�,具有實(shí)質(zhì)臨床獲益的細胞藥物和解決方案����!
士澤生物團隊全身心All In���,低調實(shí)干���,行勝于言��,持續不斷的以實(shí)際事實(shí)和結果為證��!
國“士”無(wú)雙的干細胞創(chuàng )新藥物�����,
?�!皾伞鼻f(wàn)受苦難的病患家庭����!