
近日����,霍德生物作為申辦方發(fā)起的I期注冊臨床試驗�,“評價(jià)人誘導多能干細胞來(lái)源的前腦神經(jīng)前體細胞注射液(hNPC01注射液)改善缺血性腦卒中偏癱后遺癥的劑量遞增����、單中心����、開(kāi)放標簽的安全性和耐受性的臨床研究”�����,已由湘雅醫院楊治權教授團隊順利完成了首例受試者給藥和21天的觀(guān)察�。本臨床首例入組的受試者在12月7日接受首劑量hNPC01注射液治療之后��,情況平穩����,各項指標正常���,無(wú)手術(shù)及圍術(shù)期的并發(fā)癥�,于術(shù)后3日順利出院并繼續康復鍛煉��。目前�����,首例受試者給藥后已滿(mǎn)3周����,整體狀態(tài)平穩�,自覺(jué)肌力有一定改善�����,研究團隊依照臨床試驗方案進(jìn)行了安全審查會(huì )議���,同時(shí)第二����、三例患者已入組和完成前期觀(guān)察�����,即將按照計劃進(jìn)行給藥�����。
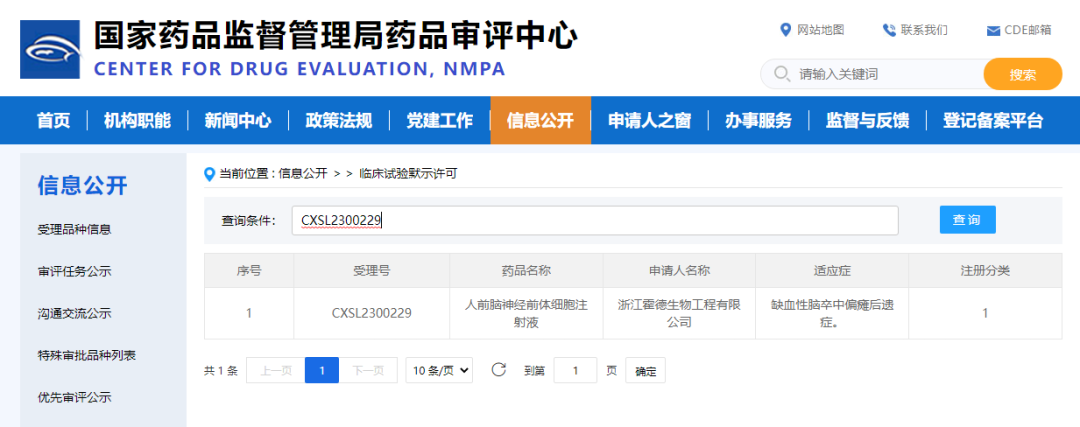
2023年6月底�,人誘導多能干細胞來(lái)源的hNPC01前腦神經(jīng)前體細胞注射液用于治療缺血性腦卒中偏癱后遺癥獲CDE臨床試驗默示許可���。這是國際第一個(gè)進(jìn)入注冊臨床的多能干細胞衍生前腦神經(jīng)前體細胞產(chǎn)品���,也是國內首個(gè)獲IND批準和完成首例注冊臨床給藥的多能干細胞衍生的神經(jīng)類(lèi)細胞產(chǎn)品�。
湘雅醫院楊治權教授表示:“本次臨床試驗首例受試者給藥已經(jīng)順利完成��,受試者給藥后3周情況良好���,且初步顯示有肌力改善的趨勢����。我們將按照臨床試驗方案的要求��,持續監測受試者治療后情況����。我們與霍德生物團隊都有非常強的合作精神與共同目標��,都希望能推動(dòng)這些創(chuàng )新的療法早日惠及更多無(wú)藥可治的偏癱患者�����?��!?/span>
霍德生物創(chuàng )始人范靖博士表示:“我們在合作中充分感受到了湘雅醫院楊治權教授團隊及臨床試驗機構�、CRO伙伴對本注冊臨床試驗的鼎力支持和高度的專(zhuān)業(yè)性��。同時(shí)也非常感謝臨床志愿者的信任和支持�����,我們從入組申請和篩選情況中可以看到腦卒中偏癱患者人群數量之大和治療意愿之強烈�����。對于按照計劃完成所有劑量入組和給藥����,公司充滿(mǎn)了信心��。我們會(huì )繼續通過(guò)內外部伙伴的努力���,以高執行力推動(dòng)高質(zhì)量的腦缺血初步安全性臨床研究���,爭取早日通過(guò)后續的確證性臨床為腦出血和腦梗偏癱后遺癥患者提供真正安全��、有效和可負擔的治療��?�!?/span>