-繼被美國FDA批準��, IMC002的IND申請已于近日獲得中國CDE的默示許可
-IMC002是首個(gè)獲得中美IND批準的基于高特異性VHH納米抗體靶向CLDN18.2的CAR-T產(chǎn)品
-高特異性VHH納米抗體賦予IMC002更優(yōu)的安全性�,正在開(kāi)展的 IIT 研究已展示了IMC002在人體中優(yōu)異的耐受性和初步療效
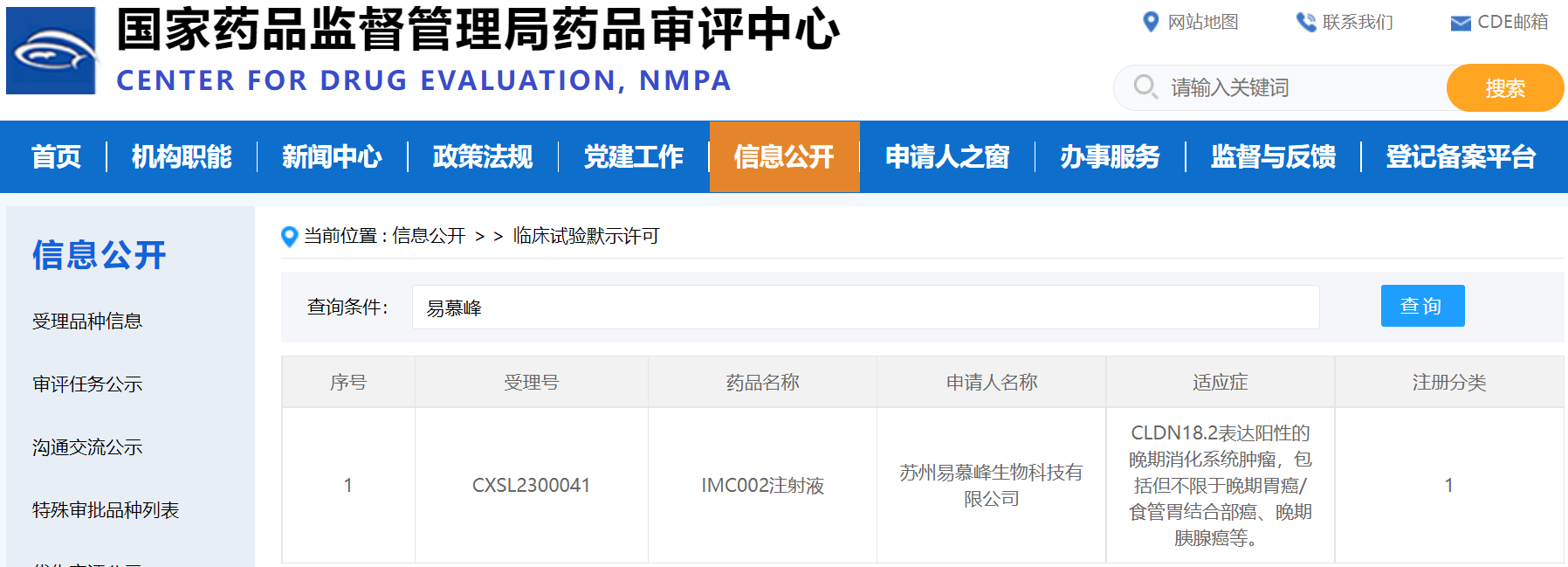
近日����,易慕峰����,一家領(lǐng)先的創(chuàng )新細胞治療產(chǎn)品開(kāi)發(fā)企業(yè)����,宣布其自研產(chǎn)品IMC002�����,即靶向CLDN18.2的自體CAR-T產(chǎn)品的IND申請獲得中國CDE默示許可��,適應癥為CLDN18.2表達陽(yáng)性的晚期消化系統惡性腫瘤�����,包括但不限于晚期胃癌/食管胃結合部腺癌��、晚期胰腺癌等��。美國FDA已于今年3月批準了該產(chǎn)品的IND申請����。
IMC002是基于高特異性VHH抗體選擇靶向CLDN18.2的自體CAR-T細胞治療藥品����,在臨床前研究以及 IIT 研究中展現出良好的安全性和有效性�。高特異性的VHH抗體將賦予IMC002更好的安全性以及潛在更大的臨床劑量窗口和適應癥范圍���。
“此次IND申請獲得中美監管機構的許可����,充分體現了團隊的產(chǎn)業(yè)化能力和高效的執行能力����,使得IMC002成為第一個(gè)同時(shí)獲得中美IND批準的基于高特異性納米抗體的靶向CLDN18.2 CAR-T產(chǎn)品”��,易慕峰創(chuàng )始人兼CEO孫敏敏女士表示:“感謝團隊的專(zhuān)業(yè)和努力付出���,相信我們會(huì )開(kāi)發(fā)出更多�����、更好的細胞治療產(chǎn)品����,為實(shí)體瘤患者帶來(lái)生存獲益�����?����!?/span>
中國人民解放軍總醫院腫瘤內科主任醫師��,IMC002中國 IT 臨床試驗主要研究者��,徐建明教授表示:“靶向CLDN18.2 CAR-T是一個(gè)非常有希望的治療手段�,但臨床上也容易發(fā)生嚴重的不良反應�。易慕峰IMC002采用的納米抗體序列特異性高����,前期數據已顯示人體耐受性極佳���,有望很好地平衡安全性和有效性����,我非常期待盡快推進(jìn)IMC002的注冊臨床試驗����?����!?/span>
關(guān)于易慕峰
易慕峰是一家致力于突破實(shí)體瘤治療���,給患者帶來(lái)長(cháng)期生存獲益的免疫細胞治療藥物開(kāi)發(fā)企業(yè)����。公司由科學(xué)家和產(chǎn)業(yè)精英合作組建�����,于2020年9月啟動(dòng)運營(yíng)���,核心成員成功推動(dòng)了中國首個(gè)CAR-T藥物的上市申請����,具有豐富的細胞藥物開(kāi)發(fā)和產(chǎn)業(yè)化經(jīng)驗��。
易慕峰從實(shí)體瘤治療痛點(diǎn)和臨床獲益出發(fā)�,在全球范圍內首次提出“化實(shí)體瘤為血液瘤”的臨床策略���,并在此基礎上開(kāi)發(fā)了Peri Cruiser?技術(shù)平臺�����,同時(shí)還開(kāi)發(fā)了SNR���、T-Booster等技術(shù)平臺��,旨在提高CAR-T產(chǎn)品的安全性��、對抗腫瘤異質(zhì)性以及提高擴增和浸潤腫瘤的能力�。
公司秉承“眾擎舉易�����,同心執慕����,勇攀高峰”的發(fā)展理念�����,集聚行業(yè)英才����,攜手開(kāi)發(fā)能夠給實(shí)體瘤患者帶來(lái)長(cháng)期生存獲益的創(chuàng )新藥物��。