近日�����,智康弘義研發(fā)的一款用于治療慢性腎臟病的全新ETA受體小分子拮抗劑SC0062膠囊通過(guò)國家藥品監督管理局(NMPA)的臨床試驗默示許可�,該款產(chǎn)品擬用于伴有蛋白尿的慢性腎臟病的治療���,包括糖尿病腎病和IgA腎病等�。
這是該公司首個(gè)獲批進(jìn)入 II 期臨床的非腫瘤項目�����,標志著(zhù)本款全新藥物的開(kāi)發(fā)邁上了全新的臺階�。
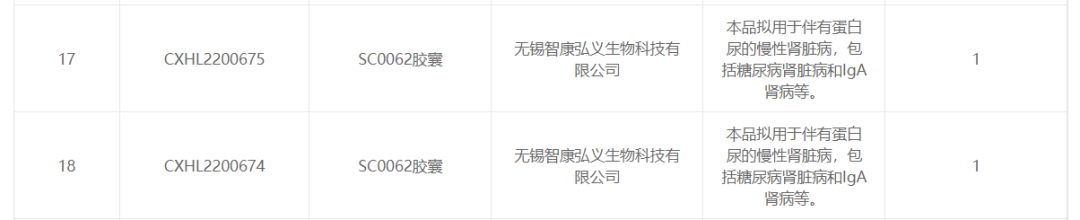
來(lái)源:國家藥監局藥品審評中心(CDE)官網(wǎng)
SC0062是全球第二款進(jìn)入臨床階段的針對慢性腎臟病開(kāi)發(fā)的ETA受體小分子拮抗劑�����,也是首款針對改善慢性疾病患者長(cháng)期用藥安全�,具有ETA高選擇性特定結構的差異化ETA產(chǎn)品��。臨床前研究表明�����,SC0062具有良好的活性�����,能夠有效改善急性腎損傷和慢性腎臟病模型的病理評分��。在已完成的臨床Ⅰ期研究中��,SC0062表現出良好的安全性和耐受性及藥代動(dòng)力學(xué)特征�����,同時(shí)未發(fā)現水鈉潴留等副作用����,有望成為潛在的“Best-in-Class”藥物����。
慢性腎臟病嚴重威脅人類(lèi)健康���,全球約有超過(guò)10%的人口(約7億多人)1受到慢性腎臟病的困擾����,中國約有1.2億潛在患者����,目前臨床中治療慢性腎臟病的手段有限��,亟需新型治療方案滿(mǎn)足尚未被滿(mǎn)足的臨床需求�����。
公司基于SC0062臨床前出色的實(shí)驗數據和已有的臨床證據及進(jìn)度優(yōu)勢���,將快速啟動(dòng)SC0062的Ⅱ期臨床研究�,加快產(chǎn)品開(kāi)發(fā)進(jìn)度��,盡早惠及患者�,滿(mǎn)足巨大的未滿(mǎn)足臨床需求���,提升患者生活品質(zhì)����。
參考文獻:
1. GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2020 Feb 29;395(10225):709-733.
關(guān)于智康弘義
“做好藥��,為生命更美好/Better Medicine for Better Life”�,是智康弘義的崇高使命�����。
智康弘義成立于2017年12月�����,公司以患者和疾病為中心���,高度重視疾病生物學(xué)在新藥研制中的基礎性作用���,以滿(mǎn)足未來(lái)重大未滿(mǎn)足的臨床需求和新場(chǎng)景為導向���,積極推動(dòng)領(lǐng)先的轉化醫學(xué)和臨床研究業(yè)務(wù)平臺化發(fā)展�����,現階段優(yōu)先專(zhuān)注于腫瘤���、腎病等疾病“First-in-Class/Best-in-Class”創(chuàng )新藥物的研發(fā)�����、臨床試驗和商業(yè)化�。
自公司成立以來(lái)�,在化學(xué)小分子����、單克隆抗體���、雙特異性抗體���、抗體偶聯(lián)藥物(ADC)等不同技術(shù)領(lǐng)域均進(jìn)行了管線(xiàn)布局��,憑借高效的研發(fā)和運營(yíng)模式���,目前已有5款新藥順利開(kāi)展臨床 I 期��、1款正在進(jìn)入臨床 II 期���,PI均由領(lǐng)域內頂級專(zhuān)家擔任�,臨床試驗的質(zhì)量和進(jìn)度延續了產(chǎn)品臨床前研發(fā)的優(yōu)勢�,大部分產(chǎn)品在國際上取得了臨床進(jìn)度上的領(lǐng)先����。公司另有多款ADC和雙抗新藥產(chǎn)品處于臨床前開(kāi)發(fā)及Pre-IND階段�。
智康弘義已組建了一支由藥物科學(xué)���、臨床醫學(xué)���、轉化醫學(xué)等交叉領(lǐng)域科學(xué)家組成的科研管理團隊領(lǐng)導各環(huán)節研發(fā)業(yè)務(wù)�����,同時(shí)配備了深耕本土�、熟悉中國環(huán)境的運營(yíng)團隊�����,系統性地保證了公司全流程研發(fā)質(zhì)量和效率��。公司將進(jìn)一步增強新技術(shù)領(lǐng)域及全球商業(yè)化的力量配置�����,以鞏固公司領(lǐng)先的綜合研發(fā)實(shí)力��,積極布局和拓展海外市場(chǎng)�����。
智康弘義正以“快速成長(cháng)為中國領(lǐng)先�����,擁有持續創(chuàng )新能力�����、核心組合產(chǎn)品�����、多樣化創(chuàng )新療法���,及深度商業(yè)化能力的生物醫藥公司”為目標���,致力于更好���、更多地造福全球患者���,為中國生物醫藥產(chǎn)業(yè)的新一輪發(fā)展貢獻力量�����。